Certaines croquettes contiennent des niveaux toxiques de contaminants environnementaux
Nous reproduisons ici un article également disponible sur le site Toxic Petfood. Nous avons en effet que les croquettes de nos animaux restent des aliments industriels, et que notre propre alimentation est concernée par la présence de nombreux éléments toxiques comme les métaux lourds.
Depuis plusieurs années, les analyses de ces aliments ont été renforcées, et si nous parlons ici des métaux lourds, c’est pour faire comprendre au consommateurs qu’il est inutile de se focaliser sur les glucides alors que les risques liés à l’alimentation industrielle concernent beaucoup de points.
Vous pouvez aussi discuter sur le sujet des métaux lourds dans les croquettes sur le forum.
Même pour les croquettes, qui ont fait dans le passé l’objet de nombreux rappels de produits, les risques sont réels, comme pour notre propre alimentation. C’est aussi pour cette raison que les réglementations deviennent plus complexes et imposent des niveaux de contrôle de plus en plus importants.
Source : https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0128429
Citation : Mesnage R, Defarge N, Rocque LM, Spiroux de Vendômois J, Séralini GE (2015) Les régimes alimentaires des rongeurs de laboratoire contiennent des niveaux toxiques de contaminants environnementaux : implications pour les tests réglementaires. PLoS ONE 10(7) : e0128429. https://doi.org/10.1371/journal.pone.0128429
La qualité des régimes alimentaires dans les essais d’alimentation des rongeurs est cruciale. Nous décrivons la contamination par des polluants environnementaux de 13 régimes alimentaires de rongeurs de laboratoire provenant de 5 continents. Les mesures ont été effectuées à l’aide de méthodologies accréditées. Tous les régimes étaient contaminés par des pesticides (1-6 sur 262 mesurés), des métaux lourds (2-3 sur 4, principalement du plomb et du cadmium), des PCDD/F (1-13 sur 17) et des PCB (5-15 sur de 18). Sur 22 OGM testés, les OGM tolérants au Roundup ont été les plus fréquemment détectés, constituant jusqu’à 48 % de l’alimentation. Le principal pesticide détecté était le Roundup, avec des résidus de glyphosate et d’AMPA dans 9 des 13 régimes, jusqu’à 370 ppb. Les niveaux étaient corrélés à la quantité d’OGM tolérants au Roundup. Les effets toxiques de ces polluants sur le foie, le développement neurologique et la reproduction sont documentés. La somme des quotients de danger des polluants dans les régimes alimentaires (estimateur de risque avec un seuil de 1) variait de 15,8 à 40,5. Ainsi la consommation chronique de ces régimes peut être considérée comme à risque. Les efforts vers des régimes alimentaires plus sûrs amélioreront la fiabilité des tests de toxicité dans la recherche biomédicale et la toxicologie réglementaire.
Introduction
Les essais d’alimentation des rongeurs sont les expériences les plus largement utilisées dans la recherche biomédicale et sont particulièrement utilisés pour étudier les effets secondaires potentiels des produits commerciaux chez les mammifères. Ils ne constituent pas seulement un test pour la santé humaine mais aussi pour l’environnement. Le rat peut également être considéré comme un modèle toxicologique pour les petits mammifères, qu’ils soient sauvages ou élevés comme animaux de ferme ou de compagnie. La qualité de l’alimentation des rongeurs est donc cruciale. Les régimes alimentaires des rongeurs sont principalement formulés avec des produits et sous-produits agricoles et sont susceptibles d’être contaminés par des contaminants environnementaux toxiques [ 1]. Cependant, l’étendue et la variabilité mondiale de cette contamination n’ont jamais été décrites. Nous avons ainsi mesuré les résidus de 262 pesticides, 22 organismes génétiquement modifiés (OGM), 4 métaux lourds, 18 biphényles polychlorés (PCB) et 17 dibenzo-p-dioxines et dibenzofurannes polychlorés (PCDD/F) dans 13 régimes alimentaires de rongeurs. Ces échantillons proviennent de 13 fournisseurs de 9 pays sur 5 continents (Amérique du Nord et du Sud, Europe, Asie, Afrique et Océanie), représentatifs des régimes utilisés dans la recherche académique et l’évaluation réglementaire.
Ces contaminations pourraient participer à expliquer pourquoi les populations de rongeurs de laboratoire à travers le monde développent des taux élevés de maladies dites « spontanées ». Par exemple, chez les rats Sprague-Dawley de Harlan après 2 ans, les incidences moyennes des fibroadénomes mammaires et des adénomes hypophysaires parmi les populations témoins étaient de 71 et 42 % respectivement [ 2 ]. La même souche de Charles River présentait en moyenne 38 % (13 à 62 %) de fibroadénomes mammaires et 71 % (26 à 93 %) d’adénomes hypophysaires [ 3 ]. De plus, ces incidences n’étaient pas stables, mais augmentaient ou diminuaient avec le temps [ 4]. Cela indique que les différences entre les populations de rats ne peuvent pas seulement s’expliquer par la dérive génétique et peuvent provenir de différentes conditions environnementales, y compris la contamination des aliments ou de l’eau. Ce travail a été mené pour tester l’étendue de la contamination des aliments provenant des 5 continents, et pour déduire les expositions et les dangers chimiques à partir des calculs officiels réglementaires (directives EPA). En effet, on sait que la mortalité des rats de laboratoire a une fourchette extrêmement inexpliquée, de 38 à 83 % après 2 ans [ 3 ] , elle est en général moindre pour certaines souches de rats Wistar [ 5 ].
Ces statistiques sont utilisées comme contrôles externes pour les tests chroniques réglementaires. Les rats traités ne sont pas seulement comparés au témoin interne de l’expérience, mais sont ensuite comparés à cette population entière, représentée par la compilation de tous les groupes témoins formés par les expériences passées du laboratoire, ou sur la souche de rat, dite « témoin historique ». données”. Les témoins historiques sont supposés être importants dans l’interprétation des tests chroniques réglementaires, et ils sont donc utilisés pour déterminer la signification biologique d’une différence statistique entre les animaux de laboratoire et les témoins concurrents. Cela ne s’applique généralement pas à la recherche universitaire, dans laquelle les groupes traités ne sont comparés qu’à des témoins appariés simultanés, élevés dans les mêmes conditions, nourris avec le même régime, à l’exception d’un paramètre étudié.
Les granulés pour rats sont majoritairement constitués de céréales (blé, maïs ou orge) et d’autres légumineuses (comme le soja). Celles-ci sont pulvérisées avec différents pesticides selon les méthodes de culture, mais aussi selon l’année ou le lieu, entraînant des contaminants différents [ 6 , 7 ]. Les pesticides sont des formulations toxiques ( Fig 1A ), censées être spécifiques aux plantes (herbicides), aux insectes (insecticides) ou aux champignons (fongicides). Cependant, les effets non ciblés de leurs résidus sont de plus en plus identifiés à des niveaux alimentaires chroniques [ 8 , 9 ]. Certains pesticides sont fortement associés aux OGM agricoles, comme le Roundup, une formulation à base de glyphosate, ou les toxines Bt mutées ( Fig 1B). Ces OGM sont essentiellement modifiés pour tolérer et/ou produire des résidus de pesticides [ 10 ] ; ils ne sont généralement pas étiquetés ni contrôlés dans leurs pays de production, notamment en Amérique du Nord et du Sud pour le soja ou le maïs OGM. Leur utilisation générale dans l’alimentation des rongeurs n’est pas documentée. Les toxiques alimentaires connus tels que les métaux lourds [ 11 ] et les dioxines [ 12 ] sont également importants à mesurer, car ce sont des contaminants omniprésents.
Nous avons collecté des échantillons d’aliments pour rongeurs sur les 5 continents, car les pratiques agricoles à divers endroits peuvent générer différents contaminants. Bien que plusieurs lots des mêmes régimes puissent ne pas être exactement égaux en termes de contaminations [ 15 , 16], l’échantillonnage multiple réalisé dans cette étude permet d’approcher la variabilité et l’omniprésence des polluants dans l’alimentation des rats. Nous avons inclus à la fois les aliments pour rats utilisés dans les essais de toxicité réglementaires (comme Purina 5002) et dans les laboratoires universitaires, mais aussi par les sociétés d’élevage, pour élever et reproduire des rongeurs de laboratoire (comme Mucedola TD.2016). Dans ce dernier cas, les rongeurs sont exposés tout au long de leur cycle de vie et à travers les générations. Pour estimer les dangers dus aux expositions chroniques à ces contaminants dans les régimes alimentaires, nous avons calculé les indices de danger chronique non cancérigène (pour tenir compte des effets toxicologiques généraux) pour tous les polluants mesurés formant des mélanges chimiques, comme recommandé par l’Environmental Protection Agency des États-Unis ( US EPA) [ 17 ] et l’Autorité européenne de sécurité des aliments (EFSA) [18 ]. Il a été utilisé récemment pour calculer le risque du consommateur de poisson pour les PCB [ 19 ] et le risque du consommateur de légumes pour les métaux lourds [ 20 ]. Cette approche suppose que des expositions simultanées sous le seuil à plusieurs produits chimiques pourraient entraîner des effets néfastes sur la santé [ 17 ].
Matériel et méthodes
Nourriture pour rongeurs
Les aliments pour rongeurs ont été obtenus directement du laboratoire utilisant les aliments ou auprès de fournisseurs des 5 continents. Les régimes alimentaires testés ont été échantillonnés en Amérique du Nord (Teklad Diets 7913 NIH 31, Wisconsin, États-Unis et Purina 5002 LabDiet, Indiana, États-Unis) ; Amérique latine (Purolab 22P, PuroTrato et NUVILAB CR1, Nuvilab Sogorb Industria e Comércio Ltda., Brésil) ; Europe (A04 Safe, France ; Mucedola S4RF21 et Harlan TD.2016, Italie, ainsi que Ssniff S8106-S011 et V1326-000, Allemagne, et 801151 RM1, Special Diet Services, Royaume-Uni) ; Afrique (crayon Belmill Mice, Belfast Millers limited, Kenya); Asie (HFK 1022 Bioscience Co, Pékin, Chine) ; et Océanie (Reliance StockFoods R94, Nouvelle-Zélande). Les granulés pour rongeurs ont été stockés à -80°C dès leur réception. Le prélèvement en triple a été précisément réalisé selon les directives 2002/63/CE.
Analyses de contaminants
Afin d’assurer l’exactitude et la reproductibilité des données (en particulier les réplications adéquates, les écarts-types et les coefficients de variations), toutes les mesures ont été réalisées dans des laboratoires accrédités par le COFRAC, l’organisme français d’accréditation. Les détails sont donnés ci-dessous. La liste des contaminants mesurés est donnée dans le tableau 1 .
Mesures de résidus de pesticides.
100 g de chaque échantillon ont été broyés dans un MaxiGrinder Solo (Genomic Industry, Archamps, France) pour assurer l’homogénéité et la représentativité, et 5 g de cet homogénat ont été extraits. Les résidus de 262 pesticides (voir le tableau 1 pour la liste détaillée) ont été mesurés une fois par échantillon par une méthode GC-MS multi-résidus et/ou LC-MS/MS après extraction/séparation à l’acétonitrile et nettoyage par extraction dispersive en phase solide. —Méthode QuEChERS [ 21] (Norme européenne et française NF EN 15662 de janvier 2009 pour les aliments d’origine végétale). Les limites de quantifications (LOQ) variaient de 10 à 100 ppb selon chaque pesticide ; les limites de détection (LOD) étaient le tiers de la LOQ. Le glyphosate (G) et son produit de dégradation, l’acide aminométhylphosphonique (AMPA), ont été déterminés par dilution isotopique et extraction en phase solide et LC-MS/MS. Ils ont été extraits à l’eau après ajout d’étalons internes de C 13 stable-isotopes. Des aliquotes ont été dérivatisées à l’aide de chloroformiate de 9-fluorénylméthyle (FMOC), puis purifiées et concentrées sur des cartouches d’extraction en phase solide. Après filtration, les extraits ont été injectés en LC-MS/MS avec ionisation par électrospray en mode ions négatifs en utilisant un suivi de réaction multiple. Les analyses ont été réalisées « one-shot ». LOD et LOQ pour la somme glyphosate + AMPA étaient respectivement de 25 et 50 ppb. Des critères de fidélité avaient été définis au préalable, lors de la validation. Les incertitudes de mesure (y compris les SD) ont été calculées à partir de l’équation d’Horwitz [ 22 ], elles variaient de 16 à 32 %, ce qui reste l’une des plus utilisées au niveau réglementaire, même si débattue [ 23 ].
Quantification des OGM.
Les quantifications d’OGM ont été réalisées par qPCR selon les normes ISO 21569, 21570, 21571 et 24276. 100g d’échantillons ont été broyés et homogénéisés dans un broyeur GM 200 (Retsch, Allemagne). 200 mg ont été utilisés pour extraire l’ADN avec le mini kit QIAsymphony DNA (Qiagen, Allemagne) et chaque sous-échantillon a été amplifié deux fois par PCR en temps réel Rotor Gene (Qiagen, Allemagne). LOD et LOQ étaient respectivement de 0,01 et 0,1 % (déterminées sur du matériel standard IRMM ou AOCS). L’incertitude globale des mesures a été calculée en additionnant l’incertitude des mesures des méthodes (calculée avec l’écart type obtenu sur les matériaux certifiés) et l’écart type des 4 répétitions par échantillon. Ces incertitudes globales variaient de 20 à 33 %. Le contenu des plantes a d’abord été déterminé par une PCR de dépistage de marqueurs spécifiques au taxon (HMG pour le maïs, lectine pour le soja, acc pour le colza, gluA3 pour la betterave sucrière, Qgene pour le blé, acp1 pour le coton, UGPase pour la pomme de terre). Ensuite, la présence de matériel génétiquement modifié a été évaluée par une PCR de dépistage de marqueurs recombinants génériques (CAMVp35S, Tnos, FMVp35S) et 22 événements spécifiques aux OGM (OGM autorisés dans les régimes alimentaires importés dans l’Union européenne) ont été recherchés dans le maïs (12) et le soja (2 ) pour tous les régimes, et en plus du colza (3), de la pomme de terre (1), de la betterave (1) et des OGM non commercialisés comme le riz et le blé, dans les 3 régimes contenant la plus forte proportion d’OGM.
Mesures des métaux lourds.
100 g de chaque échantillon ont été broyés dans un MaxiGrinder Solo (Genomic Industry, Archamps, France). Les teneurs en arsenic, cadmium, plomb ont été déterminées en double à partir de 1g de l’homogénat par spectrométrie d’absorption atomique en four graphite selon la norme NF EN 15550 (novembre 2007). La minéralisation est réalisée à l’aide de DigiPREP 48 positions (SCP Science, Courtaboeuf, France) sous pression atmosphérique, puis la teneur en arsenic, cadmium et plomb du gisement minéral est mesurée par spectrométrie d’absorption atomique en four graphite (GF-AAS) ou AAFG Zeeman pour arsenic. Les longueurs d’onde sont de 193,7 nm pour l’arsenic, 228,8 nm pour le cadmium et 283,3 nm pour le plomb. Les limites de quantification étaient respectivement de 100, 10, 100 ppb. Les incertitudes globales (y compris SD) étaient de 33 % pour l’arsenic, entre 10 et 50 % pour le cadmium et entre 38 et 46 % pour le plomb.
Le mercure est quantifié selon une méthode dérivée de la méthode US EPA 7473. Des échantillons de régime sont séchés, puis soumis à une décomposition thermique afin de libérer les vapeurs de mercure et de les amalgamer sur des fils d’or. Ensuite, les fils d’or sont désorbés thermiquement et le mercure libéré quantifié par GF-AAS. La longueur d’onde est de 253,65 nm et la limite de quantification est de 5 ppb. Les incertitudes globales étaient égales à 20 %.
Mesures PCDD/F et PCB.
La détermination des PCDD, PCDF et PCB dans les aliments pour animaux se fait en utilisant la technique GC/HRMS en combinaison avec la dilution isotopique. La préparation et l’analyse des échantillons sont basées sur la méthode EPA 8290. Des congénères de PCDD et de PCDF chlorés marqués au 13 C et des congénères de PCB marqués au 13 C sont ajoutés à différents stades de la préparation de l’échantillon afin de corriger pour d’éventuelles pertes. Tout d’abord, l’échantillon d’aliments pour animaux est broyé à l’aide d’un système de broyage Retch. L’échantillon broyé est extrait au soxhlet pendant 20 heures, après la 13Une solution standard d’extraction marquée au C a été ajoutée. La graisse, présente dans l’extrait évaporé de la solution de soxhlet, est détruite avec de la silice acide suivie d’un nettoyage mixte acide et silice basique et d’un nettoyage à l’alumine. L’extrait en devenir est évaporé et le standard d’injection est ajouté juste avant l’injection sur le système GC/HRMS.
Deuxièmement, les interférences de la matrice sont supprimées par un nettoyage à l’aide d’une colonne multicouche et d’une colonne DB5MS en alumine. Enfin, l’extrait concentré est injecté sur GC/HRMS (GC 6890 d’Agilent et série MS Autospec Ultima de Micromass). Le procédé chromatographique sépare les congénères spécifiquement recherchés des autres. Les paramètres de spectrométrie de masse donnent une séparation entre les PCDD, les PCDF et les PCB, entre les différents degrés de chloration et entre les marqués au 13 C et au 12congénères C-natifs en utilisant l’enregistrement d’ions sélectionnés à une résolution de 10 000 de deux ions sélectionnés de chaque congénère. La teneur en PCDD/F et en PCB a été déterminée HRGC/HRMS. La limite de quantification (LOQ) était de 0,05 pg/g ou ppt (sauf OCDD/F = 0,1 ppt) pour les congénères individuels impliqués dans la teneur en dioxines/furannes (PCDD/F). Pour les PCB de type dioxine, la LOQ était de 0,05 ppt pour les PCB non-ortho et de 10 ppt pour les PCB mono-ortho. La LOQ était de 100 ppt pour les PCB indicateurs. Les incertitudes globales (y compris les ET, calculées à partir de l’équation d’Horwitz) étaient de l’ordre de 30 % dans tous les cas.
Les contrôles qualité les plus importants sont 1/ la séparation entre 1,2,3,4,7,8-HxCDD et 1,2,3,6,7,8-HxCDD et entre PCB-123 et PCB-118 ; 2/ l’écart des PCDD, PCDDF et PCB natifs et marqués du témoin d’étalonnage est vérifié par rapport à la courbe d’étalonnage ; 3/ les rapports isotopiques entre les différents ions ne diffèrent pas de plus de 20% par rapport aux rapports théoriques ; 4/ le temps de rétention des congénères natifs est comparé au temps de rétention des congénères marqués ; 5/ la récupération du standard d’extraction est maîtrisée ; 6/ des échantillons de contrôle sont analysés et assimilés à une carte de contrôle ; 7/ le contrôle de la dérive est vérifié.
Calculs de quotients de risque, d’indices et d’analyses statistiques
Nous avons calculé le quotient de risque (HQ), comme le rapport de la dose journalière chronique potentielle de chaque substance à la dose de référence chronique correspondante à laquelle aucun effet indésirable n’est supposé être attendu, telle que la dose journalière acceptable (DJA). L’indice de danger (HI) est la somme de HQ. Cette méthode est recommandée par l’US EPA [ 17 ]. Ainsi, la dose journalière chronique est d’abord déduite du facteur de conversion 0,05 calculé à partir de 37 études chroniques (utilisées également pour la détermination de la DJA chez le rat) par l’EFSA [ 24]. Par exemple, une concentration de 1 ppm de contaminant dans les aliments équivaut à une dose de 0,05 ppm poids corporel/jour pour les rats adultes. Nous avons calculé les sommes de HQ (ΣHQ) pour tous les toxiques connus mesurés. Cependant, ceux-ci correspondent à une sous-estimation des effets toxiques chroniques, puisque tous les toxiques ne peuvent pas être connus. A titre d’exemple, les adjuvants donnant un effet non additif mais multiplicateur dans certains cas [ 25 ] ne sont pas pris en compte. Le coefficient de corrélation entre les OGM tolérants au Roundup et certains résidus de Roundup (G + AMPA) a été calculé selon le coefficient de corrélation produit-moment de Pearson en utilisant Stata/IC 12.1 [ 26 ].
Résultats
Pesticides
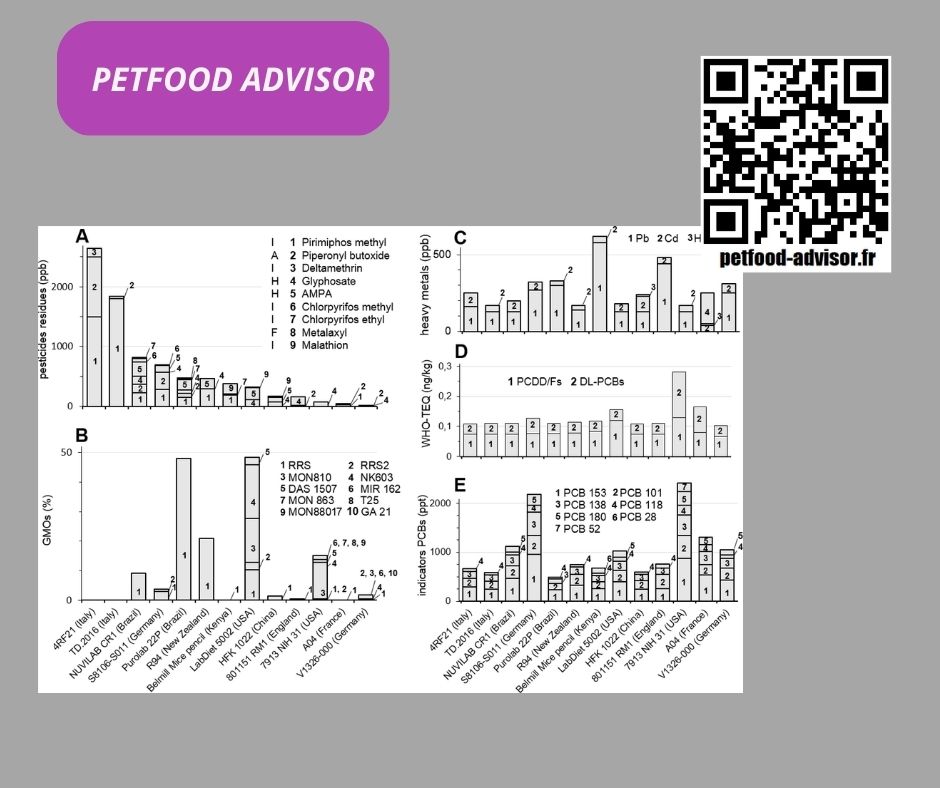
Tout d’abord, il apparaît que tous les échantillons étaient contaminés par des résidus de pesticides ( Fig 2A ), les 2 échantillons provenant d’Italie étant les plus contaminés (jusqu’à 2641 ppb). La contamination était très hétérogène, avec 1 à 6 résidus différents par aliment, le plus grand nombre de résidus de pesticides différents étant détecté dans NUVILAB CR1 (Brésil). Le pirimiphos méthyle était le résidu le plus fréquemment détecté dans 8 aliments sur 13, à des niveaux allant jusqu’à 1800 ppb dans TD.2016 (Italie). 7 régimes dépassaient la DJA ( Tableau 2 ), donc le QG était supérieur à 1, jusqu’à 22,5 dans TD.2016 ( Tableau 3). Sur les 9 résidus de pesticides détectés, 5 étaient des insecticides (pirimiphos méthyl, deltaméthrine, chlorpyrifos méthyl et éthyl, et malathion), 2 provenaient de l’herbicide Roundup ou d’autres herbicides à base de glyphosate (glyphosate et son métabolite AMPA). Il n’y avait qu’un seul résidu de fongicide, le métalaxyl. Le butoxyde de pipéronyle, détecté dans 8 échantillons, est utilisé comme synergiste dans divers pesticides.
OGM
Il s’agit de la première étude faisant état de l’étendue de l’utilisation mondiale d’OGM dans l’alimentation des rongeurs ( Fig 2B) : 11/13 échantillons étaient positifs sauf les 2 régimes italiens. L’étiquetage n’est obligatoire que dans l’Union européenne au-delà de 0,9 % par ingrédient. Sur 4 régimes européens contenant des OGM, 2 régimes allemands étaient étiquetés comme tels. Le régime français A04 ne contenait que 0,3 % de soja GM, mais le régime anglais 801151 RM1 contenait 32 ± 8 % de soja GM (0,47 % du total) et n’était pas étiqueté. Le Purolab 22 P brésilien était étiqueté (48 % de soja GM), mais le Purina 5002 LabDiet américain contenait environ 12,8 % de soja GM et 35,6 % de maïs GM et n’était pas étiqueté. Dans cette analyse, tous les événements GM ont été mesurés, qu’ils soient empilés ou non. Sur 22 événements GM spécifiques recherchés, 12 ont été détectés : 8 variétés de maïs GM, 2 variétés de soja GM et 2 variétés de colza GM. Parmi ces événements GM, 6 étaient tolérants au Roundup (soja RRS1 et RRS2, maïs GA21, MON88017 et NK603 et colza GT73), 3 étaient tolérants au glufosinate (maïs DAS1507 et T25, colza MS8RF3) et 5 ont produit la toxine Bt modifiée (DAS1507, MIR162, MON810, MON863 et MON88017 maïs). 2 ont des événements empilés (DAS 1507 et MON88017). À l’exception d’une infime quantité de colza GM (0,07 à 0,7 %), il semble que la majorité des OGM contenus soient du soja ou du maïs, mais leur quantité est très variable (0 à 48 %). Les aliments pour animaux d’Amérique du Nord et du Sud ainsi que de Nouvelle-Zélande ont la plus forte teneur en OGM. 48 % de la ration Purolab 22P (Brésil) est composée de soja Roundup Ready. Le même contenu global en OGM se trouve dans le LabDiet 5002 (USA) mais est composé de 7 événements (2 caractères pour le soja, 3 pour le maïs, 2 pour le colza). 9 événements GM différents ont été détectés au maximum dans l’aliment 7913 NIH 31 (USA), comprenant au total au moins 15 % d’OGM, composés de RRS1 et RRS2 (soja), et MON810, MON863, NK603, T25, Mir162, MON88017 et DAS 59122 (tous ces 7 événements sont dans diverses variétés de maïs GM). Les OGM ont été détectés moins fréquemment ou pas du tout dans les aliments pour animaux européens et étaient absents des aliments pour animaux africains (les OGM cultivés en Afrique sont principalement constitués de coton GM).
Les OGM agricoles sont pour la plupart tolérants au Roundup. Le maximum de résidus d’herbicide au glyphosate détecté était de 130 ppb de glyphosate et de 240 ppb d’AMPA dans NUVILAB CR1 (Brésil). La deuxième teneur en herbicide la plus élevée (310 ppb) était dans le LabDiet 5002 (USA). En fait, le glyphosate et l’AMPA, les seuls résidus d’herbicides détectés, n’ont été trouvés que dans les régimes alimentaires contenant des OGM tolérants au Roundup, et aucun herbicide n’a été détecté dans d’autres échantillons. Il existe même une corrélation positive (r de Pearson = 0,64, p = 0,019) dans tous les régimes entre le contenu de tous les OGM tolérants au Roundup et les résidus R (G+AMPA), comme le montre la Fig 3 .
Métaux lourds
Contrairement aux pesticides et aux OGM, les contaminations par les métaux lourds ( Fig 2C ) apparaissent plus homogènes. La teneur en plomb est la plus variable (jusqu’à 580 ppb pour l’alimentation kényane et 440 ppb dans l’alimentation britannique), contrairement au cadmium (30 à 100 ppb). Les aliments chinois et français étaient contaminés par de faibles niveaux de mercure (10 ppb), l’aliment français étant également contaminé par de l’arsenic (200 ppb). Concernant les seuls métaux lourds, les ΣHQ varient de 6,2 à 16,7 ( Tableau 3 ).
Dioxines et PCB
Des dioxines et des PCB ont été détectés dans tous les échantillons ( Fig 2D et 2E ). Les teneurs en PCDD/F varient entre 0,067 ± 0,019 ng TEQ/kg de poids humide (12 % d’humidité) (V1326-000, Allemagne) et 0,130 ± 0,039 (7913 NIH 31, USA). Dans ces régimes, la somme des PCDD/F et des DL-PCB est respectivement de 0,102 ± 0,029 et 0,280 ± 0,084, ce qui représente le minimum et le maximum pour tous les régimes. La somme des 6 indicateurs NDL-PCB (PCB-118 exclu) montre des teneurs encore plus variables dans les régimes : de 530 ± 310 ng/kg poids humide (PuroLab 22P, Brésil) jusqu’à 1 950 ± 640 (toujours dans le régime 7913 NIH 31, États-Unis). La consommation chronique par les rats de l’ensemble des régimes dépasse la DJA pour les PCDD/F, et pour la somme PCDD/F + DL-PCB, ainsi que pour les NDL-PCB ( Tableau 2 ) . Uniquement pour ces contaminants, les ΣHQ varient de 5,4 à 16,8 (Tableau 3 ).
ΣHQ pour tous les contaminants
Tous les régimes consommés de manière chronique atteignent un ΣHQ très élevé (15,8–40,5 ; le risque doit être soigneusement considéré au-dessus de 0,2 ou 1).
Discussion
Il s’agit du premier rapport sur la contamination mondiale mesurée avec précision des régimes alimentaires des rongeurs de laboratoire à travers le monde par les pesticides, les OGM, les métaux lourds, les dioxines et les PCB. Les effets sur la santé de la plupart de ces produits, y compris aux niveaux que nous avons trouvés, sont documentés, même si généralement les effets des mélanges sous les seuils officiels [ 27 , 28 ] ne sont pas évalués. C’est pourquoi nous avons calculé ici HQ et leurs sommes. Les résultats de ces travaux sont en accord avec le groupe CONTAM de l’EFSA [ 29 ], qui conclut que l’évaluation des risques pour la santé animale est toujours accompagnée d’un degré élevé d’incertitude et doit encore être développée.
Les contaminants et leurs niveaux trouvés dans ce travail sont cohérents avec diverses autres études. Par exemple, Zeljenkova et al. [ 30 ] mesuré dans le régime alimentaire des rongeurs de laboratoire pour une étude OGM de 90 jours 530–1600 ppb de pirimiphos-méthyl, 94–300 ppb de butoxyde de pipéronyle, 118–173 ppb d’arsenic, 0,16 ng TEQ dioxines/kg, comme dans Schecter et al . [ 31 ] et dans cet ouvrage.
Le régime alimentaire 4RF21 (Italie), qui est le plus contaminé par les pesticides, contient 1500 ppb de pirimiphos-méthyl ; cela correspond à un apport journalier chronique chez le rat de 75 ppb/pc/j, selon les valeurs calculées par défaut [ 24 ]. Ce pesticide est connu pour inhiber la cholinestérase plasmatique chez les rats traités à 200 ppb/pc/j [ 32 ]. D’autres effets pourraient se produire à des doses plus faibles, bien qu’ils n’aient pas été testés, car les effets toxiques peuvent survenir de manière non linéaire [ 33 ]. Cependant, cet apport est déjà 19 fois supérieur à la DJA. De plus, cette alimentation est également contaminée par d’autres pesticides comme la deltaméthrine (141 ppb), ce qui correspond à un apport journalier chronique chez le rat de 7 ppb/pc/j. La deltaméthrine est un initiateur de tumeur chez la souris Swiss albinos à partir de 4 ppm/pc/j [ 34]. Il est caractérisé comme un toxique neurodéveloppemental chez le rat à partir de 80 ppb/pc/j [ 35 ]. En effet, le risque est aussi amplifié par les effets de mélange car le même régime contenait 1 ppm (50 ppb/pc/j chez le rat) du synergiste butoxyde de pipéronyle, qui est ajouté aux formulations pesticides pour augmenter leurs toxicités [ 36 ] , notamment dans les pyréthrinoïdes tels que la deltaméthrine. Des adjuvants sont développés pour amplifier les effets toxiques sur les plantes, les insectes ou les champignons, ainsi que pour amplifier les effets toxiques chez les mammifères [ 25 , 37 ]. Pour les insecticides seuls avec le butoxyde de pipéronyle, le ΣHQ (somme des rapports de chaque exposition à la DJA correspondante) de ce régime est déjà de 19,7, et pour tous les contaminants pris ensemble, il atteint 40,5 (tableau 3), qui est au moins 40 fois supérieure à la limite préoccupante. De plus, cela ne tient pas compte des effets synergiques potentiels.
Un facteur de sécurité de 100 (sous le niveau sans effet nocif observé) est généralement appliqué pour le calcul de la DJA. Il tient compte à la fois de la variabilité intra (x10) et interspécifique (x10). Comme nous sommes dans tous les cas au-dessus de 10 dans le tableau 3 (15,8–40,5), ces régimes peuvent représenter un risque pour certaines espèces ou pour certains animaux au sein de l’espèce, et de plus nous n’avons pas mesuré tous les autres contaminants possibles. Toutes ces considérations pourraient expliquer, à elles seules, un éventuel taux de pathologies chroniques rapportées chez les rongeurs consommant ces régimes. Étant donné que les combinaisons de contaminants sont susceptibles de changer avec le temps et l’emplacement, les taux de pathologies chroniques ne seraient pas stables chez les rats témoins dans différentes expériences. Par conséquent, les données de contrôle historiques ne conviennent pas pour être utilisées comme contrôles généraux.
La présence de butoxyde de pipéronyle, un composé synergique de pesticide, dans 8 des 13 aliments testés, implique que les pesticides doivent être testés en formulation et non en tant que composés uniques. Les adjuvants sont rarement surveillés, mais certains adjuvants largement utilisés (tensioactifs), tels que les éthoxylates de nonylphénol, sont largement présents dans l’environnement et sont liés à des perturbations endocriniennes et reproductives de la faune [ 38 ] . Parmi les autres pesticides mesurés, le chlorpyriphos-méthyl est un perturbateur endocrinien et induit des effets anti-androgènes et une hypothyroïdie dès l’exposition prénatale [ 39 ]. La présence de ces résidus pourrait également expliquer les taux élevés de tumeurs mammaires ou hypophysaires dans les populations témoins de rats [ 40]. Des pesticides comme le malathion ou le chlorpyrifos par exemple, induisent des changements dans la glande mammaire du rat [ 41 , 42 ]. Le glyphosate induit la croissance des cellules cancéreuses du sein humain par des voies œstrogéniques à des niveaux aussi bas que 0,1 ppb [ 43 ], tout comme le Roundup à un niveau comparable pour la croissance des adénomes mammaires in vivo [ 44 ]. Le glyphosate est décrit comme un promoteur tumoral [ 45 ]. Même si davantage d’échantillonnages sont souhaitables, la corrélation entre la quantité de résidus de Roundup et d’OGM tolérants au Roundup (la majorité des OGM cultivés, à savoir NK603, RRS1 et RRS2) indique que des résidus de glyphosate se retrouvent dans les cultures agricoles d’OGM tolérants au Roundup, principalement du soja et du maïs. Ceci a déjà été décrit par Bohn et al. [ 46]. Seul le régime brésilien NUVILAB CR1 présente des niveaux de résidus doubles ou triples que ceux attendus avec la régression linéaire ; cela pourrait suggérer un nombre plus élevé de pulvérisations ou une plus grande quantité d’herbicide utilisé dans le champ, et/ou une contamination de l’eau ou du sol en raison de sa persistance, comme déjà documenté [ 47 ] .
Il n’y a pas d’autre corrélation entre la teneur en OGM et les résidus totaux de pesticides (r de Pearson = -0,21, p = 0,49). Les 4 régimes les plus riches en OGM (9 à 48 %) proviennent d’Amérique et de Nouvelle-Zélande ; c’est logique puisque le continent américain produit 95 % des OGM alimentaires, hors coton [ 10 ]. 80% d’entre eux sont tolérants au Roundup, il n’est donc pas surprenant que le glyphosate et son métabolite AMPA venant pour le Roundup aient été détectés dans l’alimentation des rongeurs nord et sud américains, où la majorité des cultures de ces cultures sont OGM. Même si les toxicités des OGM restent controversées [ 48 ], la contamination de 9/13 échantillons est préoccupante car certains aliments comme le Purina 5002, contenant 48 % d’OGM, sont utilisés régulièrement comme témoin dans les tests toxicologiques d’OGM [ 49]. Dans ce dernier cas, aucune donnée sur la présence d’OGM tolérants au Roundup ou sur les résidus de Roundup dans les aliments pour animaux n’a été fournie bien qu’il s’agisse d’informations essentielles pour les conclusions de sécurité [ 50 ]. Généralement, dans ces tests, seule la plante GM est caractérisée pour sa teneur en OGM, tandis que la quantité d’OGM dans le reste de l’aliment reste inconnue.
Concernant la contamination générale de tous les régimes par les métaux lourds bioaccumulatifs, il est étonnant que la consommation de 12 régimes sur 13 ait dépassé la DJA pour le Pb, et la totalité pour le Cd, avec un dépassement important de la norme HQ (3,0 ± 2,2 et 7,3 ± 3,1, respectivement). Même si les régimes alimentaires des rats ne suivent pas les normes humaines, 7 ont dépassé la LMR humaine pour la teneur en plomb dans diverses céréales (2 d’Allemagne et 1 du Kenya, du Royaume-Uni et du Brésil), ou pour la teneur en arsenic (France) ou en cadmium (Chine) ( Tableau 2). L’apport quotidien par les rats de tous ces régimes dépasse la DJA humaine pour le cadmium, et pour le plomb c’est le cas pour 12 régimes sur 13. Cela peut à lui seul expliquer au moins en partie certains cancers ou d’autres maladies, y compris les tumeurs mammaires chez l’animal. contrôles utilisant ces régimes, en particulier parce que le Cd est un composé de type œstrogène [ 51 ]. L’impact potentiel des différences alimentaires dans les composants nutritionnels et les contaminants, y compris les pesticides et les métaux lourds, est connu pour être un problème depuis un certain temps [ 52 , 53 ]. Il a déjà été démontré que la contamination par l’arsenic des régimes de contrôle fausse l’évaluation des risques pour les effets à faible dose des métaux lourds [ 54]. Le régime alimentaire des rongeurs français avait des niveaux d’arsenic (200 ppb) dans la fourchette de cette étude précédente, dans laquelle des souris nourries avec un régime contaminé par l’arsenic présentaient une augmentation (jusqu’à 37 fois) de l’expression génique des gènes impliqués dans les xénobiotiques (cytochromes P450) et le métabolisme du glutathion.
De même, la consommation de tous les régimes dépasse la DJA pour les dioxines, les furannes et les PCB de type dioxine (PCDD/F et DL-PCB) ainsi que pour les NDL-PCB utilisés comme indicateurs (PCB), le QG pour ces 2 groupes variant de 2,6 à 7,0 (moyenne 3,3 ± 1,2) et de 2,7 à 9,8 (moyenne 4,7 ± 2,3), respectivement. Leurs effets sur la santé sont de plus en plus documentés [ 55 ], notamment en tant qu’hépatotoxiques et perturbateurs endocriniens ainsi qu’immunosuppresseurs à des niveaux très faibles dans la gamme des contaminations mises en évidence dans notre étude ou dans un régime de rat testé par Schecter et al. [ 56 ]. Ces produits sont connus pour se bioaccumuler lors d’une exposition chronique [ 55 ]. Ils peuvent certainement contribuer à des pathologies chez les rats nourris avec ces régimes.
Les rongeurs de laboratoire sont également contaminés par des plastifiants libérés par les cages ou par les sources d’eau [ 57 – 58 ]. Dans un cas, l’effet perturbateur endocrinien des plastifiants a été découvert en raison d’une fonction endocrinienne perturbée dans les groupes témoins [ 59 ].
Il devient clair que même si le fond de pathologies des rongeurs de laboratoire témoins est dû, au moins en partie, à une alimentation ad libitum ou à une inactivité en cages fermées, induisant l’obésité, comme suggéré précédemment [ 60 ], la contamination de leur alimentation ne peut être exclue. comme cause. Certains polluants sont même obésogènes par eux-mêmes [ 61 ]. Presque tous les rats de laboratoire sont inactifs et nourris à volonté , ces facteurs ne peuvent donc pas expliquer à eux seuls les énormes différences entre les témoins dans les dossiers toxicologiques historiques [ 3 ]. Par exemple, l’incidence des fibroadénomes mammaires parmi les populations de femelles Charles River Sprague-Dawley variait de 13 à 62 % [ 3]. En fait, on sait déjà que les mêmes ingrédients alimentaires produits avec différentes méthodes de culture altèrent différemment les marqueurs biochimiques de la santé des rats [ 62 ]. Des conséquences épigénétiques sont également documentées dans de nombreux cas pour toutes ces classes de polluants, induisant éventuellement des effets transgénérationnels chez les souches de rats [ 63 – 65 ].
Prises ensemble, ces données peuvent remettre en question l’utilisation de groupes de contrôle externes dans les évaluations réglementaires des risques chroniques pour la santé, car les contaminations alimentaires différentielles renforcent artificiellement les effets de fond et masquent des effets importants. Il est donc inapproprié de combiner différents témoins provenant de différentes expériences au sein d’un même laboratoire, car différents lots d’un même aliment peuvent ne pas toujours être contaminés de la même manière au fil du temps. Les différences dans les constituants des aliments pour animaux entre les pays peuvent être encore plus importantes. Ce taux de fond de pathologies implique l’utilisation d’un grand nombre d’animaux pour détecter des différences statistiques dans l’incidence des tumeurs dans les tests de toxicité chronique. Les directives de l’organisation de coopération et de développement économiques 453 sur les tests de cancérogénicité stipulent l’utilisation d’au moins 50 animaux par groupe pour détecter les effets cancérigènes. En effet, la puissance statistique nécessaire pour détecter une différence significative entre les sujets traités et les témoins est perdue en raison du niveau élevé de tumeurs chez les témoins. Ainsi une augmentation du nombre d’animaux par groupe est proposée [66 ]. Cependant, cela n’est pas cohérent avec les préoccupations actuelles concernant le bien-être animal. Même si le tumorigramme de base des différentes espèces et souches entraînait des taux de tumeurs différents, il serait préférable de minimiser le taux de fond des pathologies en utilisant un régime alimentaire sûr et non pollué, et de limiter les comparaisons uniquement aux témoins appariés simultanés de une expérience.
Même si ces résultats remettent en cause l’intérêt des essais d’alimentation animale réalisés à ce jour, nous ne sommes pas favorables à la réduction de l’évaluation toxicologique aux seuls systèmes in vitro. Les tests sur les cellules souches embryonnaires peuvent être une première étape précieuse dans l’identification des toxiques embryonnaires, mais ils ne reproduisent pas parfaitement l’embryotoxicité [ 67 ] et ne remplaceront jamais les tests de toxicité pour le développement in vivo. De plus, pour les agents auxquels toutes les personnes à tout âge peuvent être exposées, il faut envisager de débuter l’exposition dès la vie prénatale pour permettre au potentiel cancérogène d’exprimer ses effets pendant la partie la plus vulnérable du développement [ 68 ] .
En conclusion, le fait que tous les régimes alimentaires des rongeurs de laboratoire testés soient contaminés par des produits chimiques environnementaux toxiques (moyenne ΣHQ = 23 ± 7, bien au-dessus du niveau préoccupant de 1) a d’énormes conséquences sur les pratiques actuelles de la recherche biomédicale. De plus, le HQ est rehaussé pour la souris, le jeune rat ou selon les périodes d’expositions au cours du développement car leur apport journalier est plus important [ 24 ]. L’ensemble de ces données invalide l’utilisation des données témoins historiques et remet en cause l’utilisation d’au moins 50 rats par groupe dans les études de cancérogénicité. De même et très récemment, Kuroiwa et al. [ 69] ont conclu que les incidences diverses et fluctuantes des pathologies dans les données historiques peuvent être causées par des facteurs environnementaux, plutôt que par des causes «spontanées» ou génétiques chez les rats F344. Des efforts vers des pratiques agricoles plus sûres et un meilleur contrôle des contaminants environnementaux doivent être faits afin de nourrir les rongeurs de laboratoire avec des régimes alimentaires sains. Cela améliorera non seulement la fiabilité des tests de toxicité, mais également la valeur des essais d’alimentation animale dans la recherche biomédicale.